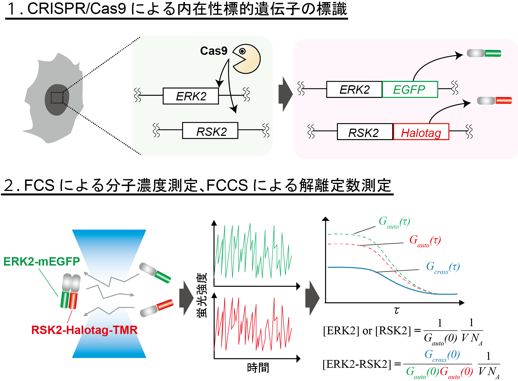
細胞が外界からの様々な刺激を受容し、それに応答するためには、細胞内で適切に情報を伝達することが必要です。このような細胞内の情報伝達では、多くのタンパク質が結合・解離や酵素反応を介して情報を伝えていくことがこれまでの研究により明らかになってきました。しかし、生きた細胞が刺激を感じる際に、それらのタンパク質が何個存在し、そのうちどれくらいの割合の分子が他のタンパク質と結合しているか、といった定量的な情報はほとんど明らかになっていませんでした。
今回、基礎生物学研究所 定量生物学研究部門/生命創成探究センター 定量生物学研究グループの小松原 晃 研究員、後藤 祐平 NIBBリサーチフェロー、近藤 洋平 助教、青木 一洋 教授らは、京都大学の松田 道行 教授との共同研究により、生きた細胞で内在性タンパク質の濃度および解離定数を測定する手法を開発しました。ゲノム編集技術により、ヒト培養細胞において細胞内情報伝達に重要な役割をもつERK2およびRSK2タンパク質をそれぞれ蛍光標識し可視化しました。この細胞を用いて、蛍光相関分光法と呼ばれる顕微鏡技術により、ERK2、RSK2それぞれの細胞内濃度を1細胞レベルで測定し、細胞内および細胞間のタンパク質の濃度のばらつきを定量化することに成功しました。さらに、蛍光相互相関分光法により、内在性ERK2とRSK2の結合を生細胞で測定し、増殖因子刺激によって結合が連続的に変化していく様子を捉えることにも成功しました。
本成果は、米国の学術誌「Journal of Biological Chemistry」に2019年4月12日付けで発表されました。
研究の背景
細胞は自身や外界からの様々な刺激を受容し応答することで、環境の変化に適応します。このような細胞内の情報伝達には、多くの情報伝達タンパク質が関わっており、さながら複雑なネットワークを構成していることが明らかになっています。これらのタンパク質は結合・解離や酵素反応といった反応を介通して情報を伝えます。この情報伝達ネットワークはその複雑さゆえに直感的に理解することが困難です。そこで細胞内状伝達ネットワーク全体をシステムとして理解するため、数理モデル化し、ネットワークの挙動をコンピューターシミュレーションする試みがなされてきました。このようなアプローチは生命をより深く理解する上で有望な手法であるものの、そのコンピューターシミュレーションには、タンパク質の濃度や、結合の強さを表す解離定数といった多くのパラメータが必要となります。過去の研究で用いられたパラメータはしばしば実測値ではなく、生細胞内の環境を正しく反映していない場合がありました。それゆえに、実験によるパラメータの測定が信頼性の高いモデルを構築する上で求められています。
シミュレーションのために必要となるパラメータは大まかに、分子の濃度、解離定数、拡散速度、酵素反応速度の4つに分けられます。これらのパラメータは、生化学的に測定するのが一般的でした。すなわち、大多数の細胞(~100万細胞)をすりつぶして抽出したタンパク質を用いるのが一般的です。しかし、このようにして抽出したタンパク質により得られた値は、大多数の細胞の平均値であるため、細胞ごとの違いや個性がわかりません。また、試験管内(in vitro)と細胞内(in vivo)の環境は大きく異なるため、in vitroとin vivoで値が異なる、という問題もありました。したがって、個々の生細胞内で測定したパラメータを知ることは重要な意味を持つと言えます。
生細胞内でパラメータを測定するのに適した技術として、蛍光相関分光法(FCS)および蛍光相互相関分光法(FCCS)があります。FCS、FCCSは共焦点顕微鏡を用いて溶液中の極小領域(約1fL、ほぼ大腸菌1つくらいの体積)における、単一あるいは複数の蛍光標識された分子の蛍光強度の時間的な揺らぎを測定し、自己/相互相関関数を計算することで、分子濃度、拡散速度、解離定数を測定する手法です。本研究グループは以前にFCCSにより測定したin vivoの解離定数(in vivo Kd)とin vitroの解離定数(in vitro Kd)は大きく解離していることを報告しています。これはin vivo Kdが翻訳後修飾や、他の結合タンパク質による競合阻害、分子混み合い、温度、pHといった様々な影響を含んだ値となっているからです。理想的には、すべてのタンパク質のすべての組み合わせに関してin vitroでパラメータを測定すればin vivo Kdを求める必要はありませんが、実際にはこれは非常に困難です。したがって、細胞内の環境やその他の分子の影響といった情報を含むin vivo Kdを測定することは、細胞内での分子間相互作用の強さを知る上で非常に有用であると考えられます。細胞で内因性に発現するタンパク質のFCSやFCCSによるパラメータ測定は出芽酵母でなされた例があったものの、哺乳類細胞においてはゲノム編集の難しさから標的遺伝子を蛍光標識することができなかったために報告されていませんでした。
研究の成果
本研究グループは、ゲノム編集技術であるCRISPR/Cas9を用いて内在性のERK2とRSK2を蛍光標識した細胞株を作製しました。まず、ERK2をコードするMAPK1遺伝子座の3’末端に相同性をもつ配列と緑色蛍光タンパク質mEGFP、選択マーカーdTKneoを含む遺伝子カセットをCas9とともにHeLa細胞へ導入し、薬剤による選択を経た後、mEGFPの蛍光をもつ細胞を単離しました。これによりmEGFPによって標識された内在性ERK2(ERK2-mEGFP)を持つHeLa細胞を樹立しました。ERK2-mEGFPの発現を確認した後、組み換え酵素CreによってdTKneoを切除しました(図1A)。次に、ほぼ同様の戦略によって、内在性RSK2もタグ配列HaloTagで標識しました。HaloTagに結合する蛍光分子TMR-ligandで細胞を処理し、共焦点顕微鏡で観察したところ、予測どおり細胞質において局在するERK2-mEGFP、RSK2-HaloTag-TMRの蛍光が確認できました(図1B)。
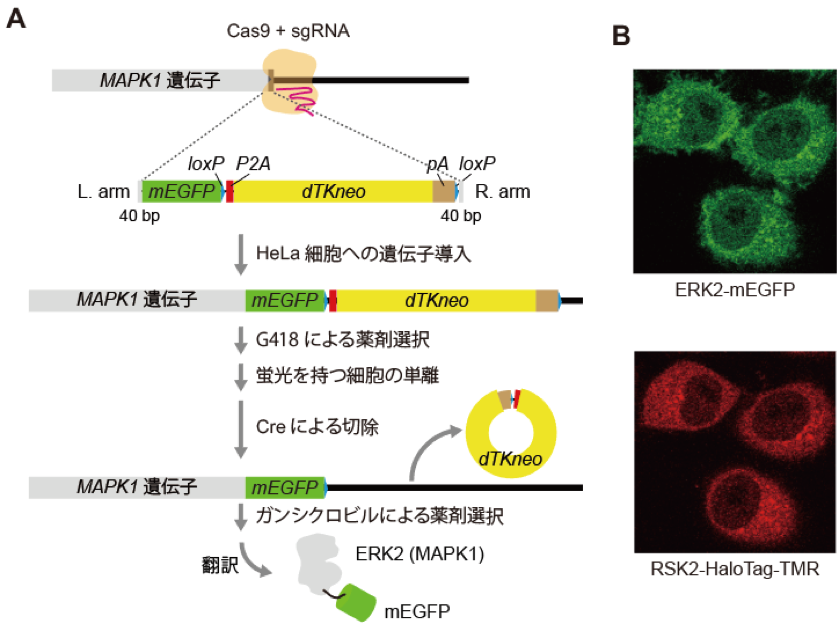
A. MAPK1(ERK2)へのmEGFP挿入の模式図。選択マーカーdTKneoは翻訳後、P2A配列によってERK2-mEGFPと分離する。
B. 標識した内在性ERK2とRSK2の蛍光画像。HaloTagはTMR-ligandによって染色。
次に、FCSを用いて内在性のERK2とRSK2の濃度が細胞毎にどの程度ばらついているかを調べました(図2A)。測定したERK2、RSK2濃度の平均値はそれぞれ0.078uMと0.097uMでした(図2B)。また、興味深いことにERK2とRSK2の濃度にはある程度の相関が認められました(図2B)。次にERK2の細胞内における濃度の差異を調べ(図2C)、細胞間における濃度の差異と比較したところ、ほぼ同程度のばらつきでした(図2D)。これらの結果から、細胞間の内在性ERK2濃度のばらつきは、細胞内のばらつきよりもかなり小さいことが分かりました。FCSでは観察する体積が非常に小さいため、細胞内小器官などの影響により濃度がばらつくことが考えられます。このように考えると、ERK2とRSK2の間に正の相関が見られたことがうまく説明されます。
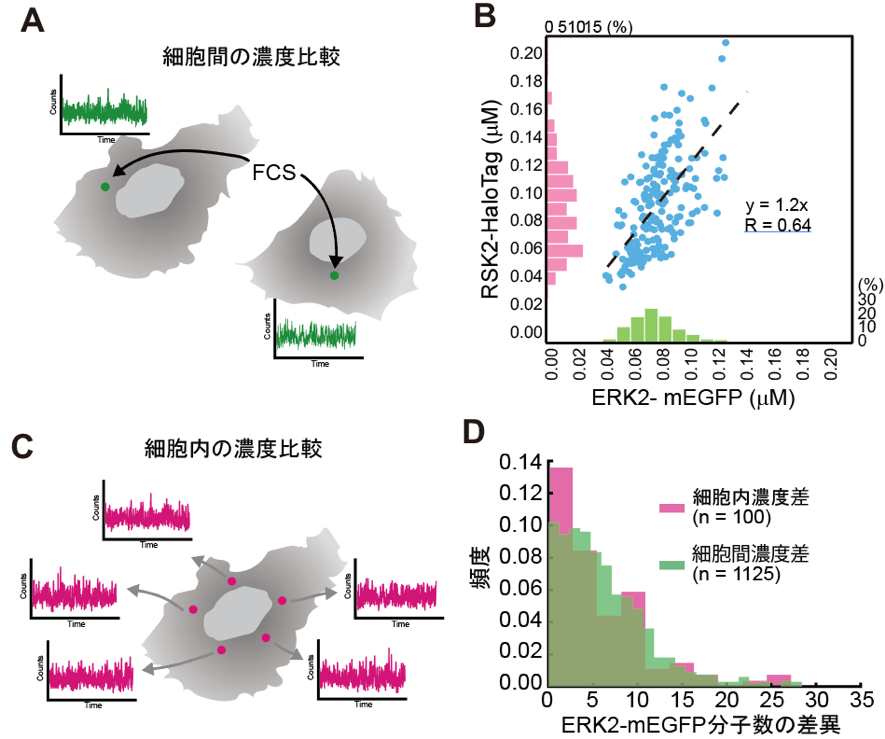
A. 各細胞におけるERK2、RSK2濃度測定の模式図。
B. 内在性ERK2-mEGFP、RSK2-HaloTagそれぞれの濃度分布と散布図。
C. ERK2細胞内濃度比較の模式図。1細胞につき5点を測定しその中から2点ずつ選んで、計10通りの比較を行った。
D. 内在性ERK2-mEGFPの細胞内、細胞間それぞれにおける濃度差。ここでは濃度のばらつきをFCS観察領域中に存在する分子数の差で表している。
最後に、FCCSを用いて内在性ERK2とRSK2間の結合の強さである解離定数を測定しました(図3A)。解離定数は、その値が小さいほど結合が強いということを意味します。得られた解離定数の平均値は0.59 μMで、興味深いことに過去にERK2-mEGFP/RSK2-Halotagを過剰発現させて行った実験で得られた解離定数(1.3 μM)よりも低い値でした。これは過剰発現させた場合よりも内在性ERK2/RSK2が強く結合しているということを意味しており、内在性足場タンパクにより結合が促進された影響ではないかと考えられました。また、上皮細胞増殖因子EGFを投与すると細胞質でのみ内在性ERK2/RSK2の解離定数が上昇、すなわちERK2とRSK2の結合が弱くなるということが分かりました(図3B)。刺激により活性化したERK2は核内に移行することが広く知られていますが、この結果は、細胞質のERK2が刺激によりRSK2と解離することで、核内に移行するということを示唆しています。
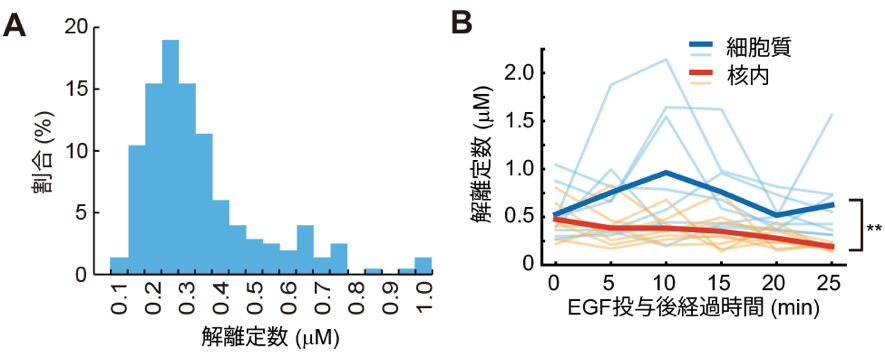
A. 内在性ERK2/RSK2間解離定数の分布
B. 内在性ERK2/RSK2間解離定数のEGFによる変動
これらの結果から、CRISPR/Cas9法による蛍光標識とFCS/FCCSを組み合わせることで、単一細胞における内在性タンパク質のパラメータを測定することが可能であることが示されました。
今後の展望
今後の展望の1つとして、ゲノム編集をさらに推し進めて分子濃度の網羅的解析を行い、シグナルネットワークのモデルに還元することが考えられます。また、本手法により抗がん剤などの薬剤の候補分子の効果をより定量的に調べることができると考えられます。
発表雑誌
雑誌名
Journal of Biological Chemistry
掲載日
2019年4月12日
論文タイトル
Single-cell quantification of the concentrations and dissociation constants of endogenous proteins
著者
Akira T Komatsubara, Yuhei Goto, Yohei Kondo, Michiyuki Matsuda, Kazuhiro Aoki
DOI
https://doi.org/10.1074/jbc.RA119.007685
研究グループ
本研究は、基礎生物学研究所/生命創成探究センターの青木 一洋 教授、京都大学大学院生命科学研究科の松田 道行 教授による共同研究グループの成果です。
研究サポート
本研究は、AMED創薬等ライフサイエンス研究支援基盤事業 生命動態システム科学推進事業「多次元定量イメージングに基づく数理モデルを用いた動的生命システムの革新的研究体系の開発・教育拠点」、科学技術振興機構CREST(JPMJCR1654)、文部科学省科学研究費助成事業・新学術領域「共鳴誘導で革新するバイオイメージング」(16H01425、18H04754)「生物の3D形態を構築するロジック」(16H01447)、基盤研究(B)特設分野(16KT0069)、基盤研究(B)(18H02444)、堀科学芸術振興財団、中島記念国際交流財団の支援のもと行われました。
発表機関
自然科学研究機構 基礎生物学研究所
自然科学研究機構 生命創成探究センター
本研究に関するお問い合わせ先
基礎生物学研究所 定量生物学研究部門
生命創成探究センター 定量生物学研究グループ
教授 青木 一洋(アオキ カズヒロ)
TEL: 0564-59-5235
E-mail: k-aoki_at_nibb.ac.jp ※_at_は@にご変更ください。
報道担当
基礎生物学研究所 広報室
TEL: 0564-55-7628
Fax: 0564-55-7597
E-mail: press_at_nibb.ac.jp ※_at_は@にご変更ください。
自然科学研究機構 生命創成探究センター 広報担当
TEL: 0564-59-5504
Fax: 0564-59-5226
E-mail: press_at_excells.orion.ac.jp ※_at_は@にご変更ください。